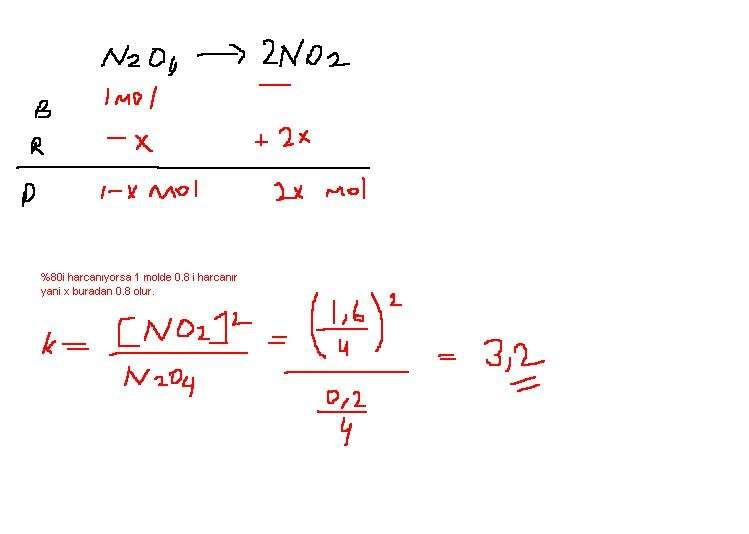s-1)4 litrelil bir kapta 1 mol N2O4 gazı bulunmaktadır.bu gaz sabit sıcaklıkta N2O4(g) −−2 NO2(g) denk.göre dengeye ulaştığında N2O4 ün %80 inin harcandığı belirleniyor.denge abiti? cvp=3,2
s-2)X2(g) +Y2(g) −−2XY(g) denge sabiti 0,25 tir.aynı sıcaklıkta 0,5 litrelik bir kaba 2 mal X2 ve 2 mol Y2 konularak tepkime başlatılıyor.tepkime dengeye ulaştığında XY nin derişimi kaç molar olur? (cvp=1,6)
s-3)H2(g) +I2(g) −−2 HI tepkimesi belirli bir sıcaklıkla 1 litrelik bir kapta 0,1 molH2 ,0,1 mol ı2 VE 0,5 MOL HI ile dengededir.tepkime kabına bir miktar HI konulup yeniden denge kurulduğunda H2 nin mol sayısının 0,12 olduğu belirleniyr. buna göre kaba kaç ml HI eklenmiştir? (cvp=0,14)
s-4) (ph=13 ve 50 ml ve KOH dolu bir kap yanda verilmiş.)şekildeki kapta bulunan çözeltinin üzerine ph si2 olan HCI çözeltisinden kaç mL eklenirse çözelinin ph si 7olur? (cvp=500)
şimdiden teşekkürler