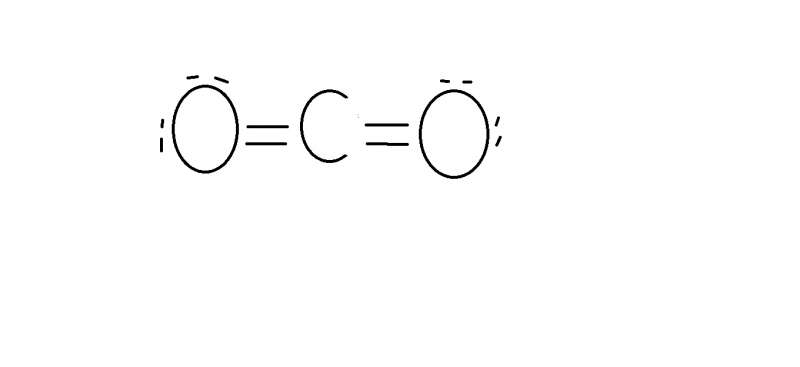
CO_2'nin Lewis yapısı neden böyle gösteriliyor? Yani, Oksijen'in her köşesinde birer nokta olmalı değil miydi? İkişer ikişer yerleştirilmiş, önceki bir bilgiyle çelişince kafam karıştı.
Sanırım elementlerin etrafına tek tek elektron konulmasıyla çelişti.
Buradaki Lewis yapılarında ortaklanmamış elektronlara yalın çift diyoruz; dolayısıyla çift halinde yazıyoruz.
Bağ yapan elektronlara ise bağ çifti diyoruz.
Kabule bağlı olduğu için net bir şekilde açıklamak zor.
İyi günler.
Buradaki Lewis yapılarında ortaklanmamış elektronlara yalın çift diyoruz; dolayısıyla çift halinde yazıyoruz.
Bağ yapan elektronlara ise bağ çifti diyoruz.
Kabule bağlı olduğu için net bir şekilde açıklamak zor.
İyi günler.
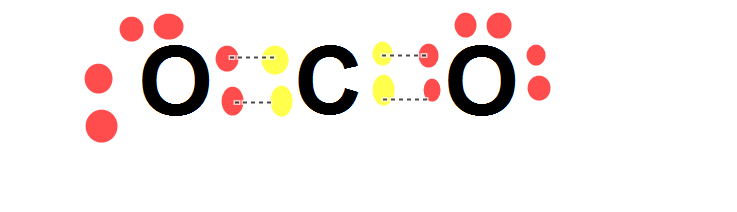
Oksijenin her tarafında birer nokta olmamasını şöyle açıklıyoruz , Oksijenler Karbonla bağ yaparken tüm elektronlar bir güç aktarımı yapacağından tüm elektronlar arasında güçlü bir etkileşim olacak (Bağ yaparken) bu durumda elektronlar yanyana gelecek.Kimyacı bu şekilde özetliyoruz demişti.
Maalesef bahsettiğin durumda hata var, sanırım öğretmenimiz daha rahat anlaşılması için öyle anlatmış.
Lewis yapıları molekülle ilgili ayrıntılı bilgi verirler; VSPER kuramını ve molekül orbital teoriyi kullanıyoruz. Çizdiğimiz Lewis modeli gerçek dünyada doğru değil, sadece VSPER yorumunu yaparken kullanıyoruz.
Elektronların yan yana gelmesi daha çok molekül orbital teorisiyle alakalı bir durum. Bir orbital iki elektron alabiliyor, burada da elektronları bir orbitele girip eşleşmiş şekilde gösteriyoruz, ancak Lewis yapısı ile bir doğrudan ilgisi yok.
İyi günler.
Lewis yapıları molekülle ilgili ayrıntılı bilgi verirler; VSPER kuramını ve molekül orbital teoriyi kullanıyoruz. Çizdiğimiz Lewis modeli gerçek dünyada doğru değil, sadece VSPER yorumunu yaparken kullanıyoruz.
Elektronların yan yana gelmesi daha çok molekül orbital teorisiyle alakalı bir durum. Bir orbital iki elektron alabiliyor, burada da elektronları bir orbitele girip eşleşmiş şekilde gösteriyoruz, ancak Lewis yapısı ile bir doğrudan ilgisi yok.
İyi günler.
Orasını bilemiycem de , molekül geometrisiyle ilgili bir durum dediler bize , yani bu sene dizilişe önem vermeyin dediğin gibi orbitallerle ilgili bir şeyler demişti , ozaman (Seneye) öğretilecek dedi.Bilemicem orasını ama en mantıklı açıklama bu bence.
anlaşıldı arkadaşlar, çok teşekkür ediyorum
