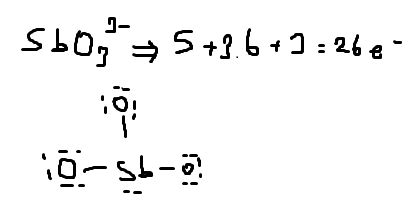1
3 g C ile 4 g oksijenin artansız tepkimesinden 7g karbon monoksit (CO) elde edilir.
3 g C ile 8 g oksijenin artansız tepkimesinden 11 g CO_2 elde edilir.
Buı bilgilerle
Kütlenin korunumu
Sabit oranlar kanunu
Katlı oranlar kanunu
hangileri ile ilgili yorum yapılabilir? (tümü)
2
Eşit hacimli kaplardan birinde X diğerinde Y gazı vardır.
Sıcaklıkları ve basınçları eşit olan bu gazların, hangi değerleri eşittir?
(mol sayıları)(bilgi sorusu, ama nedenini anlayamadım.)
3
Dalton, "atomlar parçalanamaz veya yeniden yapılandırılamaz" der.
Hangisi buna ters düşer?
atomlar arası elektron alışverişi
atomlar arasında elektronların ortak kullanılması
atomun elektroliz ile bileşiğinden serbest hale geçmesi
atomun beta ışıması yapması (cevap)
metal atomlarının elektriği iletmesi
4SbO₃³⁻ iyonunda Sb'nin yüklseltgenme basamağı nedir? (+5)(+3 buldum)
5Hangi iyonun yükü 3-'dir?
hidroksit
nitrat
sülfat
siyanür
nitrür
6
halojenlerde grup içinde yukarıdan aşağı inildikçe neden çekirdekteki tanecik sayısı artar?
Sınırı aştım bugün ama öğrenmeliyim, hakkınız helal ediniz.