YGS Kimya Konu Özeti, YGS Kimya Notları,Konu Özetleri
Altın Değerinde Notlar YGS'ye girecekler mutlaka okusun.
(Kendi notlarımdır hiç bir yerden alıntı değildir...)
-------------------------------------------------------------------------
*Metaller ve alaşımlar elektron hareketi ile elektiriği iletir. Asit baz ve tuz çözeltileri iyon hareketi ile elektiriği iletir.
→Alkol ve şeker çözeltileri ise elektirik akımını iletmez. (Moleküler yapıdadır, değerlik elektron yoktur.)
*Maddelerin potansiyel enerjisini tanecikler arası mesafe belirler.
*Buharlaşma hızı:
Sıvının,
→Uçuculuğu
→Temas yüzeyi
→Sıcaklığı
ile doğru orantılıdır.
→Sıvı içinde çözünmüş katı madde miktarı ve dış basınçla ters orantılıdır.
*Buhar basıncı yalnızca 3 faktöre bağlıdır.
→Sıvının Cinsi
→Sıvının Saflığı
→Sıvının Sıcaklığı
*Aynı noktada kaynamakta olan sıvıların buhar basınçları eşittir.
*Kaynama noktası 3 faktöre bağlıdır.
→Sıvının cinsi
→Sıvının saflığı
→Dış basınç
** Katısı sıvısında yüzen maddelerde (örn: su) basınç artışı erime noktasını düşürür kaynama noktasını yükseltir.
** Katısı sıvısında batan maddelerde basınç artışı hem erime hem de kaynama noktasını yükseltir.
*Tuzlu su kaynamaya başladıktan sonra doygunluğa ulaşıncaya kadar sıcaklığı artar ancak buhar basıncı değişmez. (Karışımlar için genelleme yapılabilir)
*Kütlenin korunumu kanunu→Lavosier
*Sabit Oranlar Kanunu→ Prost
*Katlı Oranlar Kanunu→Dalton
*Birleşen Hacim oranları Yasası→Avagadro
*Son katmana kalan elektron sayısı 9 ya da 10 ise en dıştan 2. katmana 8 elektron kalan 1 ya da 2 elektron en dış katmana yerleştirilir.
örn: 2)8)8)1 ve 2)8)8)2 gibi.
*Son katmana kalan elektron sayısı 10 dan fazla ise en dış katmana 2 elektron sondan bir öncekine kalanlar yazılır.
2)8)9)2 ve 2)8)14)2 gibi.
*Bağ polarlığında eşit çekilip çekilmeme söz konusu, Farklı tür elementler arasında olması ise molekül polarlığı ile alakalıdır.
* Sadece C ve H den oluşan organik bileşikler hidrokarbonlar olup, tamamı apolardır.
*Asitler Hidrojenden aktif metallerle tepkimeye girerek tuz ve H₂ gazı oluşturur.
*Kuvvetli bazlar amfoter metallerle (Zn,Al,Cr,Sn,Pb) tepkimeye girerek tuz ve H₂ oluştururlar.
*Asitler baz çözeltilerle nötralleşme tepkimesi verir.
*Asitler Karbonatlı bileşiklerle tepkimeye girerek CO₂ gazı oluşturur.
*Pasif metaller Cu,Hg,Ag = (Yarı soy) ve Pb,Au=(soy metal) olup, bunlardan yarı soy olanları H₂SO4 ve HNO₃ ile tepkimeye girerler ancak, H₂ oluşturamazlar.
*Ametallerin oksijenli bileşiklerine asidik oksit, Metallerin oksijenli bileşiklerine bazik oksit denir.
*Ametallerin, oksijen saysından çok ya da eşit olduğu bileşikler nötr oksitlerdir.
*Organik bileşikler, yanıcı, suda çözünmez, yavaş tepkimeli ve kokuludur.
*Yapısında pi bağı yani çift bağ içermeyenlerine alkanlar denir CnH2n+2 genel formülleridir.
*Alkenler çift bağ içerir genel formülleri CnH2n dir.
*Alkinler üçlü bağ içerir genel formülleri CnH2n-2 dir.
*Yanma tepkimelerinin gerçekleşmesi için oksijenin tutuşma sıcaklığında olması gerekir. Yanma tepkimeleri genellikle ekzotermiktir.
→Her yanma olayı redoks tepkimesidir.
*Asit-Baz tepkimelerinin tamamı ekzotermiktir ve redoks değildir, yer değiştirme tepkimesidir. **
*Yapısında ikili veya üçlü bağ bulunduran moleküller polimerleşebilir yani alkanlar polimerleşme tepkimesi vermez.
→Eğer polimerleşme sırasında su gibi yan ürün çıkarsa, kondenizasyon polimerleşmesi denir.
*Analiz: Ayrışma, Sentez: Oluşmadır.
**Çözünürlüğe etki eden faktörler:
→Çözücü çözünen türü
→Ortak iyon etkisi, ortak iyonun derişimi artıkça çözünürlüğü azalır.
→Basıncın etkisi: Katı ve sıvıların çözünürlüğüne basıncın etkisi yoktur. Gazların çözünürlüğü ile doğru orantılıdır.
→Sıcaklığın etkisi: Sıcaklık arttıkça katı ve sıvıların çözünürlüğü genellikle artar, gazların çözünürlüğü azalır.
*Çözünürlüğü endotermik olan bir maddenin A noktasındaki doymamış çözeltisini doyurmak için:
*Ya bir miktar çözünen eklemeli
*Ya çözücü buharlaştırılmalı
*Ya da çözeltinin sıcaklığı azaltılmalı.
Çözünürlüğü ekzotermik olan bir A maddesini doyurmak için:
*Ya bir miktar çözünen eklemeli
*Ya bir miktar çözücü buharlaştırılmalı
*Ya da sıcaklık artırılmalıdır.
*Temas yüzeyini artırma çözünme hızını artırır, çözünürlük değişmez.
*Sabunda baş kısmı hidrofil, kuyruk kısmı hidrofobdur.
*Sabun ve deterjanlar hem temizleyici hem de dezenfektan özellik gösterir.
*Sert sularda sabunun temizleme özelliği azdır, deterjanlar sert sularda bile etkilidir.
* Sabunun yapı taşı bitkisel ve hayvansal yağlardır, deterjanların yapı taşı ise petrol ve türevleridir.
*Sabun doğal yapılı olduğundan deterjana göre çevre dostu ve daha az zararlıdır.
*Çamaşır sodası suda çözündüğünde bazik bir ortam oluşturur. Çamaşır sodası (Na₂CO₃) Sodyum bi karbonat yağı temizler.
*Çamaşır suyu (NaClO) sodyum hipoklorit mikrop öldürücü ve temizleyicidir.
*CaCO₃(kireç taşı) =>(sıcaklıkla) CaO(k)(sönmemiş kireç)+CO₂(g)
CaO(k)+H₂O=>Ca(OH)₂(k) (sönmüş kireç) +ısı
Ca(OH)₂+CO₂=CaCO₃ (kireç taşı) +H₂O
*Seramik: Işığı geçirmez, yapısı gözenekli, suyu geçirir, sıcaklık basınç değişimine dayanıksız.
*Porselen: Işığı geçirir, gözeneksiz, suyu geçirmez, sıcaklık ve basınca dayanıklı.
Altın Değerinde Notlar YGS'ye girecekler mutlaka okusun.
(Kendi notlarımdır hiç bir yerden alıntı değildir...)
-------------------------------------------------------------------------
*Metaller ve alaşımlar elektron hareketi ile elektiriği iletir. Asit baz ve tuz çözeltileri iyon hareketi ile elektiriği iletir.
→Alkol ve şeker çözeltileri ise elektirik akımını iletmez. (Moleküler yapıdadır, değerlik elektron yoktur.)
*Maddelerin potansiyel enerjisini tanecikler arası mesafe belirler.
*Buharlaşma hızı:
Sıvının,
→Uçuculuğu
→Temas yüzeyi
→Sıcaklığı
ile doğru orantılıdır.
→Sıvı içinde çözünmüş katı madde miktarı ve dış basınçla ters orantılıdır.
*Buhar basıncı yalnızca 3 faktöre bağlıdır.
→Sıvının Cinsi
→Sıvının Saflığı
→Sıvının Sıcaklığı
*Aynı noktada kaynamakta olan sıvıların buhar basınçları eşittir.
*Kaynama noktası 3 faktöre bağlıdır.
→Sıvının cinsi
→Sıvının saflığı
→Dış basınç
** Katısı sıvısında yüzen maddelerde (örn: su) basınç artışı erime noktasını düşürür kaynama noktasını yükseltir.
** Katısı sıvısında batan maddelerde basınç artışı hem erime hem de kaynama noktasını yükseltir.
*Tuzlu su kaynamaya başladıktan sonra doygunluğa ulaşıncaya kadar sıcaklığı artar ancak buhar basıncı değişmez. (Karışımlar için genelleme yapılabilir)
*Kütlenin korunumu kanunu→Lavosier
*Sabit Oranlar Kanunu→ Prost
*Katlı Oranlar Kanunu→Dalton
*Birleşen Hacim oranları Yasası→Avagadro
*Son katmana kalan elektron sayısı 9 ya da 10 ise en dıştan 2. katmana 8 elektron kalan 1 ya da 2 elektron en dış katmana yerleştirilir.
örn: 2)8)8)1 ve 2)8)8)2 gibi.
*Son katmana kalan elektron sayısı 10 dan fazla ise en dış katmana 2 elektron sondan bir öncekine kalanlar yazılır.
2)8)9)2 ve 2)8)14)2 gibi.
*Bağ polarlığında eşit çekilip çekilmeme söz konusu, Farklı tür elementler arasında olması ise molekül polarlığı ile alakalıdır.
* Sadece C ve H den oluşan organik bileşikler hidrokarbonlar olup, tamamı apolardır.
*Asitler Hidrojenden aktif metallerle tepkimeye girerek tuz ve H₂ gazı oluşturur.
*Kuvvetli bazlar amfoter metallerle (Zn,Al,Cr,Sn,Pb) tepkimeye girerek tuz ve H₂ oluştururlar.
*Asitler baz çözeltilerle nötralleşme tepkimesi verir.
*Asitler Karbonatlı bileşiklerle tepkimeye girerek CO₂ gazı oluşturur.
*Pasif metaller Cu,Hg,Ag = (Yarı soy) ve Pb,Au=(soy metal) olup, bunlardan yarı soy olanları H₂SO4 ve HNO₃ ile tepkimeye girerler ancak, H₂ oluşturamazlar.
*Ametallerin oksijenli bileşiklerine asidik oksit, Metallerin oksijenli bileşiklerine bazik oksit denir.
*Ametallerin, oksijen saysından çok ya da eşit olduğu bileşikler nötr oksitlerdir.
*Organik bileşikler, yanıcı, suda çözünmez, yavaş tepkimeli ve kokuludur.
*Yapısında pi bağı yani çift bağ içermeyenlerine alkanlar denir CnH2n+2 genel formülleridir.
*Alkenler çift bağ içerir genel formülleri CnH2n dir.
*Alkinler üçlü bağ içerir genel formülleri CnH2n-2 dir.
*Yanma tepkimelerinin gerçekleşmesi için oksijenin tutuşma sıcaklığında olması gerekir. Yanma tepkimeleri genellikle ekzotermiktir.
→Her yanma olayı redoks tepkimesidir.
*Asit-Baz tepkimelerinin tamamı ekzotermiktir ve redoks değildir, yer değiştirme tepkimesidir. **
*Yapısında ikili veya üçlü bağ bulunduran moleküller polimerleşebilir yani alkanlar polimerleşme tepkimesi vermez.
→Eğer polimerleşme sırasında su gibi yan ürün çıkarsa, kondenizasyon polimerleşmesi denir.
*Analiz: Ayrışma, Sentez: Oluşmadır.
**Çözünürlüğe etki eden faktörler:
→Çözücü çözünen türü
→Ortak iyon etkisi, ortak iyonun derişimi artıkça çözünürlüğü azalır.
→Basıncın etkisi: Katı ve sıvıların çözünürlüğüne basıncın etkisi yoktur. Gazların çözünürlüğü ile doğru orantılıdır.
→Sıcaklığın etkisi: Sıcaklık arttıkça katı ve sıvıların çözünürlüğü genellikle artar, gazların çözünürlüğü azalır.
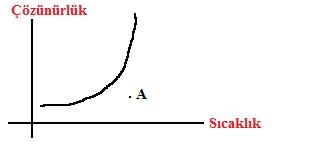
*Çözünürlüğü endotermik olan bir maddenin A noktasındaki doymamış çözeltisini doyurmak için:
*Ya bir miktar çözünen eklemeli
*Ya çözücü buharlaştırılmalı
*Ya da çözeltinin sıcaklığı azaltılmalı.
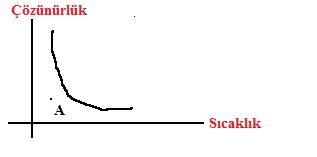
Çözünürlüğü ekzotermik olan bir A maddesini doyurmak için:
*Ya bir miktar çözünen eklemeli
*Ya bir miktar çözücü buharlaştırılmalı
*Ya da sıcaklık artırılmalıdır.
*Temas yüzeyini artırma çözünme hızını artırır, çözünürlük değişmez.
*Sabunda baş kısmı hidrofil, kuyruk kısmı hidrofobdur.
*Sabun ve deterjanlar hem temizleyici hem de dezenfektan özellik gösterir.
*Sert sularda sabunun temizleme özelliği azdır, deterjanlar sert sularda bile etkilidir.
* Sabunun yapı taşı bitkisel ve hayvansal yağlardır, deterjanların yapı taşı ise petrol ve türevleridir.
*Sabun doğal yapılı olduğundan deterjana göre çevre dostu ve daha az zararlıdır.
*Çamaşır sodası suda çözündüğünde bazik bir ortam oluşturur. Çamaşır sodası (Na₂CO₃) Sodyum bi karbonat yağı temizler.
*Çamaşır suyu (NaClO) sodyum hipoklorit mikrop öldürücü ve temizleyicidir.
*CaCO₃(kireç taşı) =>(sıcaklıkla) CaO(k)(sönmemiş kireç)+CO₂(g)
CaO(k)+H₂O=>Ca(OH)₂(k) (sönmüş kireç) +ısı
Ca(OH)₂+CO₂=CaCO₃ (kireç taşı) +H₂O
*Seramik: Işığı geçirmez, yapısı gözenekli, suyu geçirir, sıcaklık basınç değişimine dayanıksız.
*Porselen: Işığı geçirir, gözeneksiz, suyu geçirmez, sıcaklık ve basınca dayanıklı.
Elene sağlık 
Faydalı olur inşallah. 
Eline sağlık Duygu. Çok zahmet etmişsin.
Ne zahmeti hocam. Seve seve. 
eline sağlık duygu
Faydali olabildiysem ne mutlu. 
